芳香族和杂芳香族分子的合成是设计许多理想农用化学品和药物的基础。通过选择性地将碳-氢键(C-H)转化为 C-X 键(其中 X 通常为氧、氮或碳),可以实现其化学多样性。这种 C-H 与硼(B)的官能化特别有用,因为 C-B 键可以很容易地转化为各种取代基,从而形成相关化合物的构件。然而,通过 C-H 硼酰化作用对芳香环上的特定位置进行官能化是一项挑战。最通用的 C-H 硼酰化方法之一是使用含铱的催化剂,铱是一种昂贵且极其稀有的过渡金属 。利用芳香基质的立体特性,并借助与催化剂金属中心结合的官能团和螯合剂,通常可以完全控制芳香环上被选择性硼烷基化的位置 。然而,通过非定向 C-H 硼化作用选择性地对芳香基质的理想位置进行官能化是一项挑战,也就是说,如果不首先将金属配位和定向到环上的目标位点附近,就会在 C-H 键处发生特定的修饰。由于铱的反应活性较低,因此也很难用含量更高的金属(元素周期表第一行的金属)代替铱。在此,普林斯顿大学Paul J. Chirik教授课题组描述了由 N-烷基咪唑取代的吡啶二碳烯(ACNC)钳配体支持的钴前催化剂,该催化剂可实现氟芳烃的非定向远程硼化,并将范围扩展到富含电子的炔烃、吡啶以及三氟和二氟甲氧基化的炔烃,从而解决了第一排过渡金属 C-H 功能化催化剂的主要局限性之一。机理研究表明,尽管临位C-H 活化产生的钴芳基络合物在热力学上更受青睐,但在间位位置上对C-H键活化具有动力学偏好。因此,使用单一前催化剂初步证明了 C-H 硼化反应中可切换的位点选择性与硼试剂的关系。相关成果以“Kinetic and thermodynamic control of C(sp2)–H activation enables site-selective borylation”为题发表在《Science》上,第一作者为Jose B. Roque。

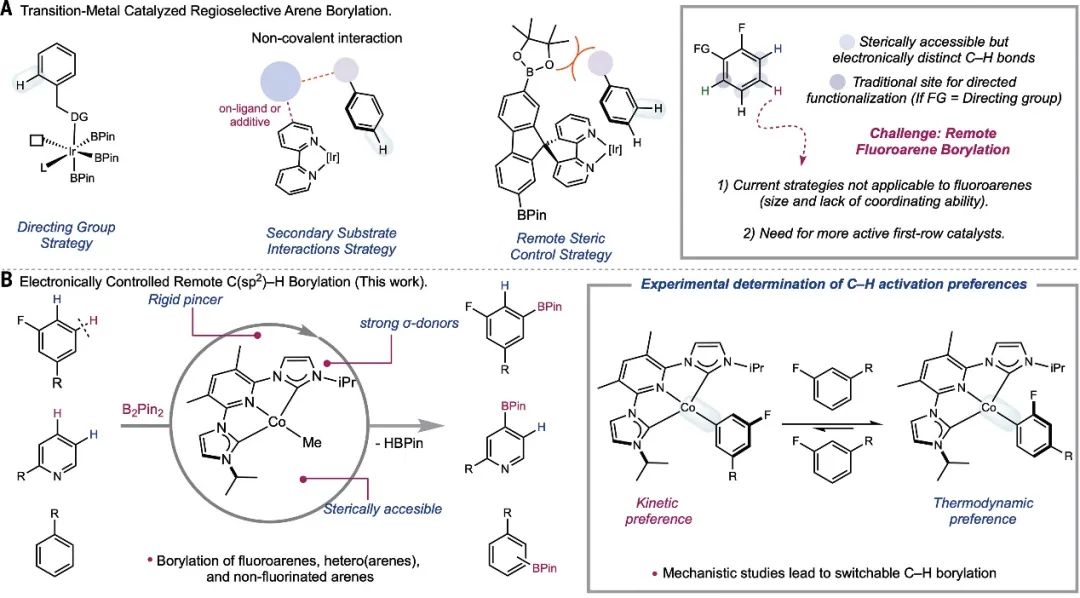
图1:.背景和催化剂开发
合成预催化剂此研究始于 3,5-Me2-(iPrACNC)Co(Br)2(3-Br2)的合成。由于双(螯合物)金属络合物的竞争性形成倾向,这类带有较少立体束缚的 N-烷基而非立体束缚的 2,6-二芳基取代基的钳形钴-烷基络合物一直难以获得。为了规避这一问题,作者开发了一种优化的程序,将 3,5-Me2-(iPr ACNC)(HBr)2 (S1) 加入到含有过量 Co(HMDS)2 的冷 (-95°C) 己烷溶液中。得到了一种红色固体,产率为 93%,经 X 射线衍射表征为 3-Br2(图 2A)。向 3-Br2 在二乙醚中的悬浮液中加入 2.1 等量的 MeLi,然后过滤,随后在苯-d6 中通过质子核磁共振 (1H NMR) 光谱进行分析,确定形成了一种具有二磁性的 C2v 对称钴化合物,并形成了 CH3D。通过这一过程获得的单晶体确定了产物的身份,即钴芳基复合物 3-C6D5,它是由假定的钴甲基复合物进行 C-D 活化而产生的。在四氢呋喃(THF)中重复这一过程可以分离出 3-Me,将产物溶解在苯-d6 中可以迅速生成钴-苯基络合物,从而建立了简便的 C-H 活化反应性。
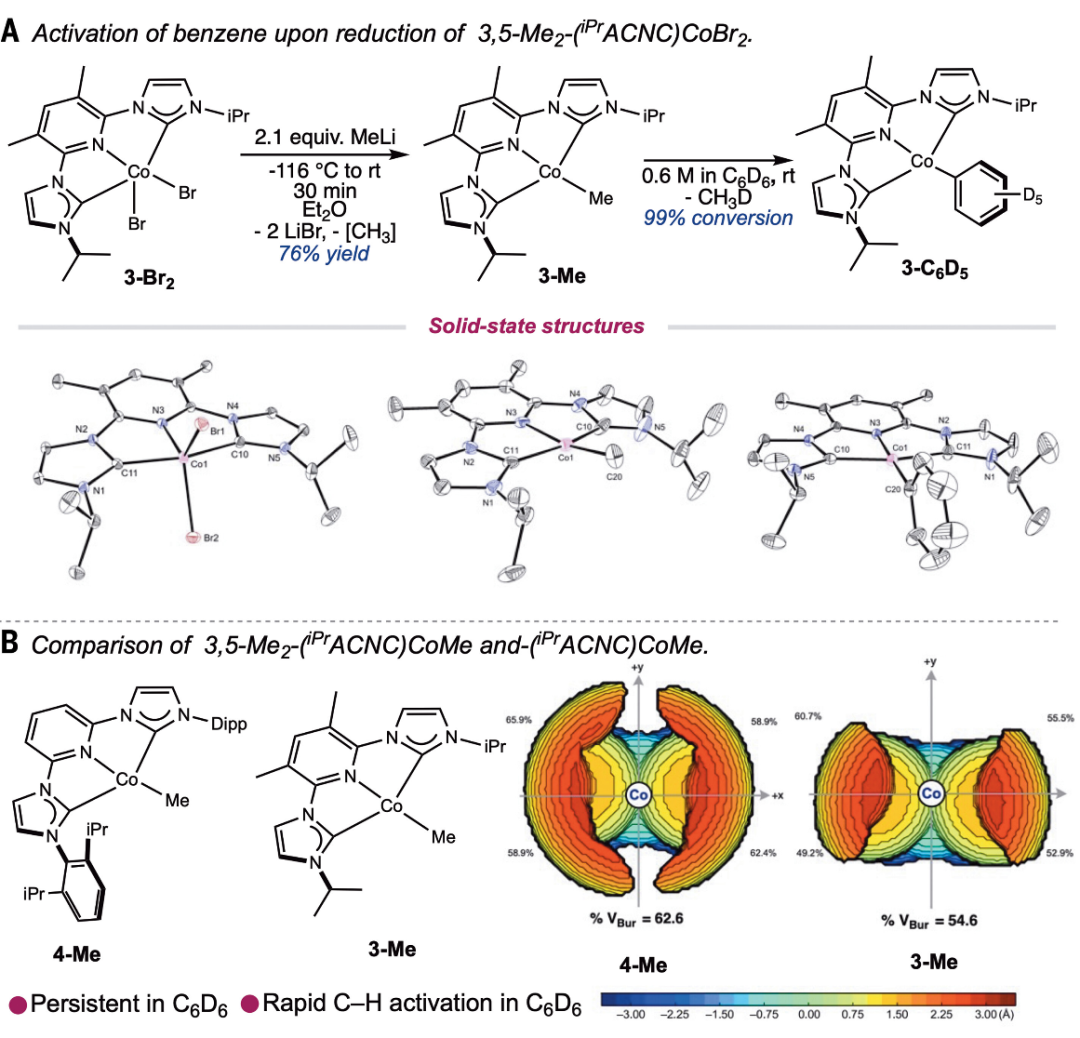
图 2.预催化剂的合成和表征
反应开发鉴于苯的快速活化,作者对 3-Me 的 C(sp2)-H 硼化活性进行了评估(图 3)。在使用 3-Me 的情况下,产率和催化剂控制的高间选择性均有所提高,这凸显了基于 NHC 的钳形钴前催化剂的优越性能。对一系列含有官能团的 2,6-二氟芳基进行了研究,在所有情况下都获得了高产率(>80%)和高选择性(>87:13 m:o)。观察到对位对硼和对位对氟的选择性与底物无关,这凸显了 3-Me 对底物修饰的不敏感性,并为混合二芳基醚提供了一种更通用、合成上更有用的 C-H 硼酰化途径。
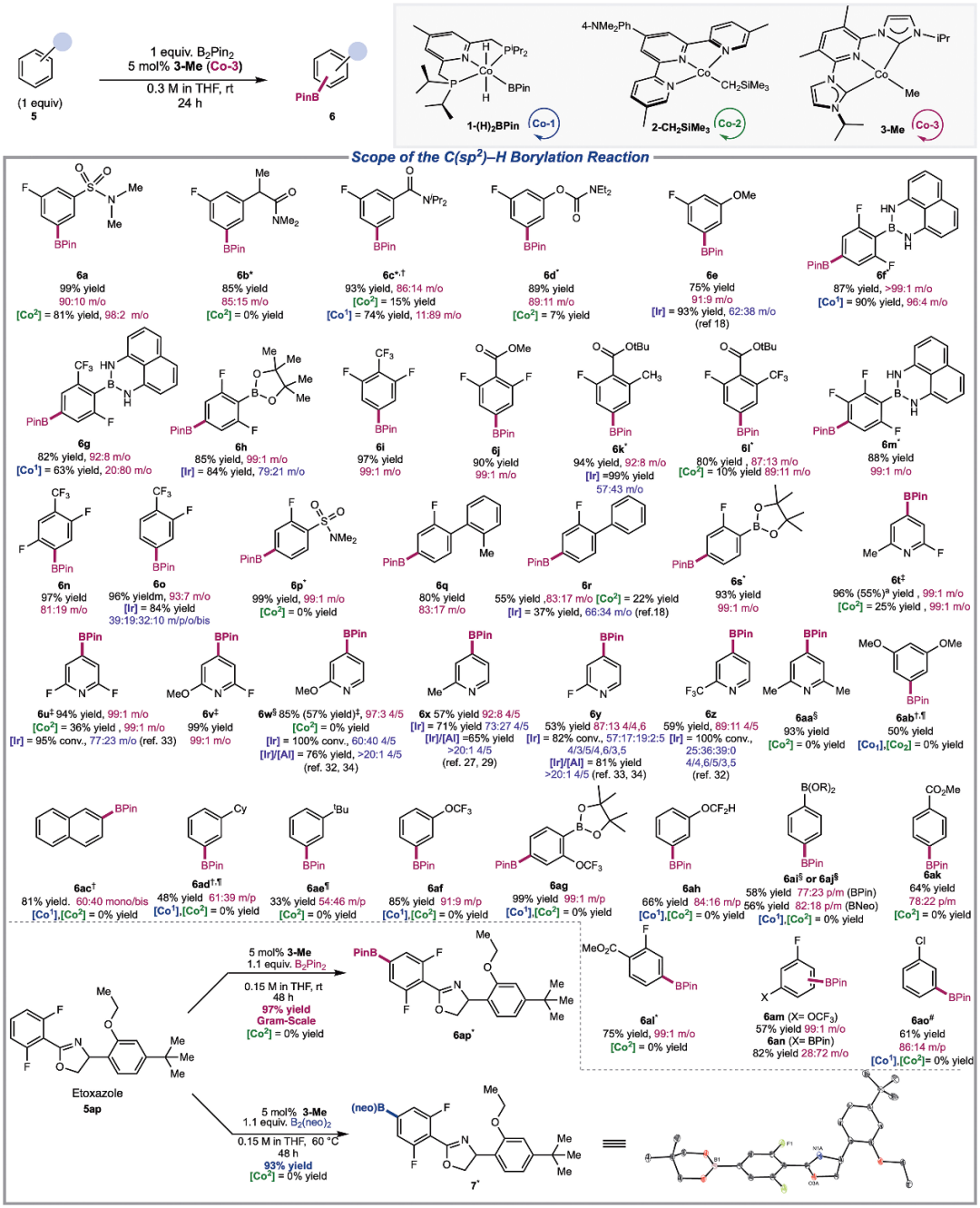
图 3.C(sp2)–H硼化(杂)芳烃
机理研究为了深入了解 C-H 硼化选择性的来源,作者研究了与催化相关的钴(I)-氟芳基络合物的合成。在室温下用过量的氟芳烃 (8) 处理 3-Me 的苯-d6 溶液,在正对氟位点的 C-H 活化作用下形成了相应的钴 (I)- 芳基配合物 3-ArF(图 4A)。19F NMR 光谱没有检测到与 3-ArF 异构体相对应的其他信号。为了探究钴芳基复合物生成后分子内异构化或频哪醇硼烷(HBPin)诱导的异构化,研究人员考察了 3-ArF 与 HBPin 的反应。用过量的 HBPin 处理 3-ArF 后,只形成了邻-对氟硼烷基化产物(图 4A)。为了合理解释导致邻-Co(I)-芳基复合物的化学计量实验与在元位点 C-B 键形成的催化反应中观察到的主要产物之间的差异,作者通过核磁共振光谱监测了 3-Me 与一系列氟代烯烃的化学计量反应。在整个实验过程中,19F NMR 光谱都没有观察到对位异构体的存在(图 4B)。此外,结果还表明,发生钴芳基异构化需要过量的氟烯烃。这说明,在间位氟的位置上,C-H 的活化具有动力学上的优先性,而邻异构体的形成则具有热力学上的优先性。利用密度泛函理论(DFT)计算了氟芳基异构体的自由能,结果证实了实验观察结果,即由于热力学上的邻氟效应,3-(2,6-C6H3F2) 的能量最低(图 4B)。由于金属芳基络合物通常是通过在金属卤化物前体中加入有机金属试剂合成的,因此缺乏反应活性,因此以前没有关于第一排金属的这些趋势的实验支持报道。
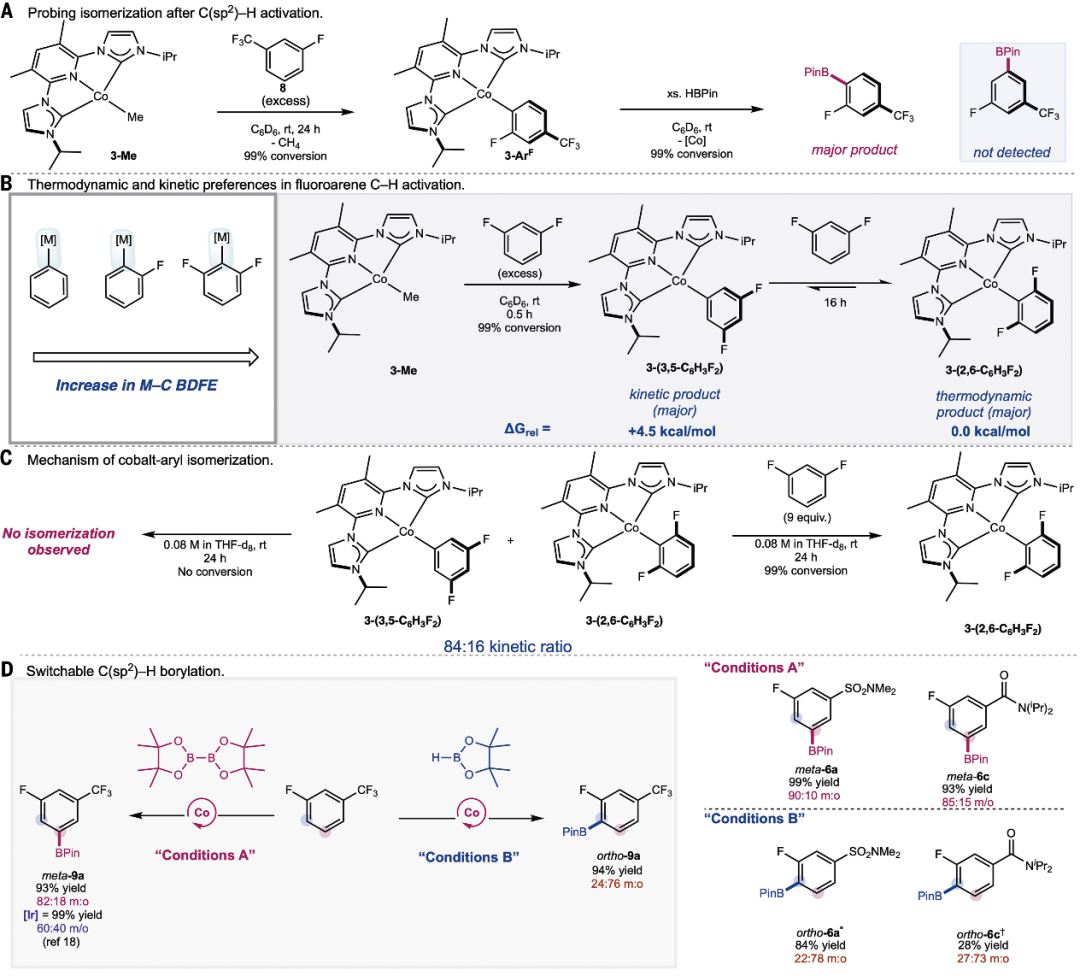
图 4.机理考虑以及动力学与热力学选择性
展望:未来的发展肯定会进一步用于氟化化合物的硼化中空间衰减钴配合物。因此,预计复杂分子和药物的后期 C-H 硼化将取得突破。钳形配体与非贵金属和主族元素的结合将为新型反应性提供未来机会。
转载:材料科学前沿


